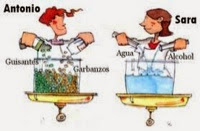
Son materiales que contienen dos o más sustancias simple, que pueden ser separadas tomando como base las propiedades características de cada una de ellas. Su composición es variable.
La materia puede presentarse en dos formas distintas, homogéneas y heterogéneas, según que sean completamente uniformes, esto es, que sus propiedades y composición sean las mismas en cualquier punto de la misma o bien que esté formada por dos o más porciones diferentes, separadas por la superficie definidas a través de las cuales las propiedades cambian bruscamente.
Un material heterogéneo es una mezcla y cada porción homogénea de la misma constituye, desde el punto de vista químico, una fase. Los componentes individuales en una mezcla heterogénea están físicamente separados y pueden observarse como tales. Estos componentes se pueden recuperar por procedimientos físicos, como la filtración, la decantación o la separación magnética.
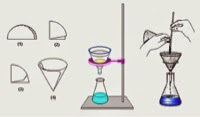
Filtración: separa sólidos de líquidos. Cuando un sólido no es soluble se hace pasar la mezcla a través de un material poroso, una tela o un papel filtro.
Decantación: separa un líquido de otro líquido que se encuentran formando un mezcla heterogénea en la cual uno de los líquidos flotará y el otro se hundirá, facilitando su separación.
Magnetismo: algunas sustancias tienen propiedades magnéticas, es decir, son atraídas por imanes. Para reconocerlas se pone un imán que atrae las sustancias magnéticas y las separa de las que no lo son.
En una mezcla homogénea o disolución el aspecto y la composición son uniformes en todas las partes de la misma. El componente que está en mayor proporción y que generalmente es líquido se denomina disolvente, y el que está en menor proporción soluto. Las disoluciones pueden ser sólidas y gaseosas, pero la mayoría de ellas son líquidas. Para separar los componentes de una disolución se utilizan técnicas como la cromatografía, la destilación, evaporación o la cristalización fraccionada.
Destilación: separa mezclas homogéneas generalmente liquidas. Se basa en el punto de ebullición de los líquidos. Cuando el líquido que alcanza la ebullición primero comienza a pasar a estado de vapor, se mantiene la temperatura de tal manera que no se eleve y el otro líquido no ebulla. El vapor del líquido que embulle se enfría para recuperarlo en forma de líquido en otro recipiente.
Evaporación: separa líquidos de sólidos, por efecto de calentamiento, el líquido alcanza su punto de ebullición y se evapora dejando el sólido en el recipiente que contiene la mezcla.
Cristalización: este método se basa en los puntos de solidificación de los componentes de la mezcla a separar. La solución se enfría, cuando uno de los componentes inicia su proceso de solidificación se mantiene contante la temperatura para evitar que el segundo componente comience también a solidificarse o cristalizarse. Cuando la primera sustancia se cristaliza queda libre las partículas de la otra sustancia que formaba parte de la mezcla.
Cromatografía: este método se basa en la separación de una mezcla por dispersión de la misma, utilizando diluyentes que distribuyen los componentes de la mezcla a través de un material como el papel en el caso de la cromatografía de papel. Hay otras clases de cromatografía como la de gases, en capa fina, en líquido, en fase de vapor, que basan sus diferencias en el material utilizado para dispersar los componentes de la mezcla inicial. El nombre de cromatografía se debe a que en la parte visible, en la separación de la mezcla, se diferencian los colores de los componentes de la misma. Cromo = color






No hay comentarios:
Publicar un comentario