Una solución (o disolución) es una mezcla de dos o más componentes, perfectamente homogénea ya que cada componente se mezcla íntimamente con el otro, de modo tal que pierden sus características individuales.
Una solución que contiene agua como solvente se llama solución acuosa.
Características de las soluciones (o disoluciones):
* Sus componente no pueden separarse por métodos físicos simples como decantación, filtración, centrifugación, etc.
* Sus componentes sólo pueden separase por destilación, cristalización, cromatografía.
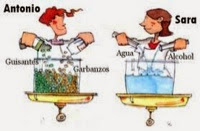
* Los componentes de una solución son soluto y solvente.
Soluto, es aquel componente que se encuentra en menor cantidad y es el que se disuelve, puede ser sólido, líquido o gas.
Solvente, es aquel componente que se encuentra en mayor cantidad y es el medio que disuelve al soluto. Aunque un solvente puede ser un gas, líquido o sólido, el más común es el agua.
Las disoluciones son mezclas de dos o más sustancias, por lo tanto se pueden mezclar agregando distintas cantidades: Para saber exactamente la cantidad de soluto y de solvente de una disolución se utiliza una magnitud denominada concentración.
La concentración se refiere a la cantidad de soluto que hay en una masa o volumen determinado de solución o solvente. Dependiendo de su concentración, las disoluciones se clasifican en diluidas, concentradas, saturadas, sobresaturadas.
Diluidas: si la cantidad de soluto respecto del solvente es pequeña. Ejemplo: una solución de 1 gramo de sal de mesa en 100 gramos de agua.
Concentradas: si la proporción de soluto con respecto del solvente es grande. Ejemplo: una disolución de 25 gramos de sal de mesa en 100 gramos de agua.
Saturadas: se dice que una disolución está saturada a una determinada temperatura cuando no admite más cantidad de soluto disuelto. Ejemplo: 36 gramos de sal de mesa en 100 gramos de agua a 20º C. Si intentamos disolver 38 gramos de sal en 100 gramos de agua, sólo se disolvería 36 gramos y los 2 gramos restantes permanecerán en el fondo del vaso sin disolverse.
Sobresaturadas: disolución que contiene mayor cantidad de soluto que la permitida a una temperatura determinada. La sobresaturación se produce por enfriamientos rápidos o por descompresiones bruscas. Ejemplo: al sacar el corcho a una botella de refresco gaseoso.
Para determinar la concentración en las disoluciones:
Porcentaje en masa (% masa) = (masa de soluto / masa de disolución) . 100
Porcentaje en volumen (% volumen) = (volumen de soluto / volumen de disolución) .100